Please log in to read this in our online viewer!
Please log in to read this in our online viewer!
No comments yet. You can be the first!
What did others read after this?
Content extract
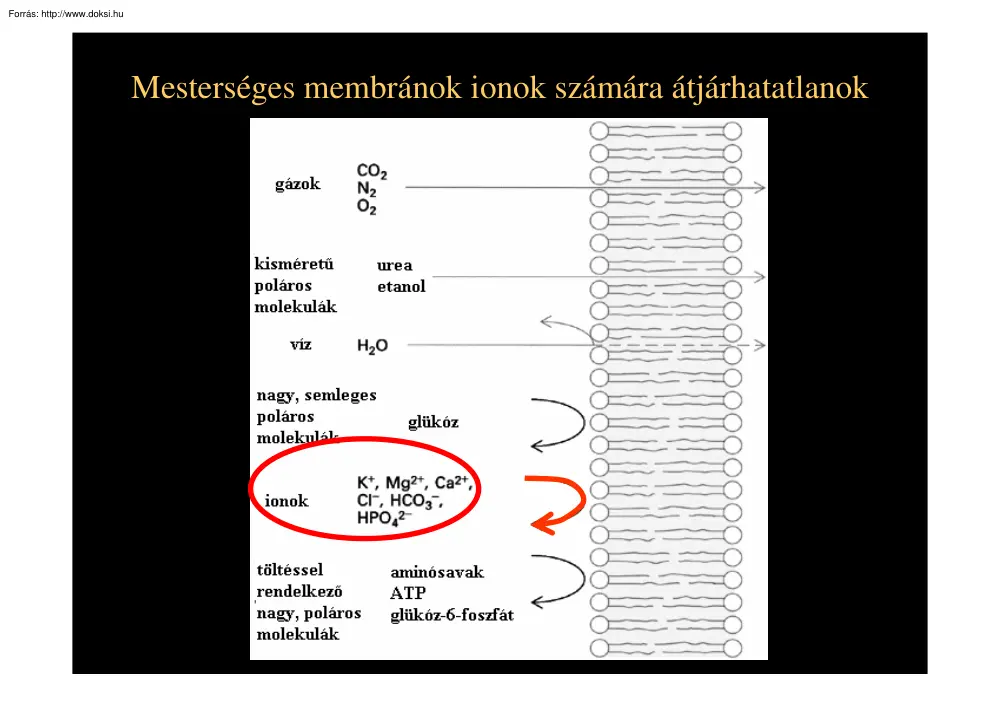
Mesterséges membránok ionok számára átjárhatatlanok Az ioncsatornák az integráns (transzmembrán) proteinek közé tartoznak Nobel Prize, Chemistry, 2003 Roderick MacKinnon for structural and mechanistic studies of ion channels Crystal structure of the voltage gated potassium channel, S5-S6 Peter Agre, for the discovery of water channels Az ion csatornák membránon keresztüli transzport folyamatok egyik külön csoportját képezik. Az összes transzport folyamat között ez a leggyorsabb, akár 4 nagyságrenddel nagyobb sebesség mint a transzporterek által elérhető maximum. zárt ATP függő pumpa nyitott ion csatorna transzporter Az ioncsatorna működése egyszerűen hajtóerő + nyitott kapu Æionáram hidrofil pórus a membránon keresztült A transzport jellemzője: az elektrokémiai gradiensnek megfelelő irányba ionok áramlása egyensúly esetén nincs nettó áram ha nincs egyensúly nettó áram [K+]o=5 mM Em [K+]o=5 mM Em
[K+]i=140 mM + RT [K ] i EK = − ln + = E m = −89 mV zF [K ] o [K+]i=140 mM + RT [K ] i ∆Ψ K = − ln + = −89 mV zF [K ] o T= 37 oC, z=1 ∆ψm= – 60 mV I = G(Em–EK)= 0 I = G(Em–EK) ≠ 0 Az ioncsatornák hidrofil bélésű, az ionok számára kedvező fizikokémiai környezetű pórust képeznek a membránban. Két alapvető tulajdonsággal rendelkeznek e pórusok, melyek alapján a csatornák osztályozhatók. kapuzás = megfelelő “inger” hatására bekövetkező konformáció változás a fehérjében, mely a csatornák különböző állapotaihoz vezet (pl. zárt, nyitott , inaktivált állapotok). Szelektív permeabilitás = csak bizonyos fajta ion (vagy ionok) számára átjárható a pórus (pl. nagy szelektivitású, kis szelektivitású, és nem szelektív csatornák). Kapuzás I. A csatornák felosztása a nem vezető (zárt) és vezető (nyitott) állapot közötti átmenetet kiváltó inger alapján: feszültség kapuzott= a
membránpotenciál megváltozása az inger (pl. idegsejtek depolarizáció aktiválta K+ és Na+ csatornái). ligand kapuzott = i.c hírvivő molekula Membrán feszülés által kapuzott a ligand bekötő- által kapuzott = a dése az extracellu- ligand bekötődése (“stretch gated”) csatorna = a láris oldalon az intracelluláris membrán feszülése jelenti az ingert oldalon jelenti az jelenti az ingert (pl. (p.l ideg-izom ingert (pl a Ca2+ limfociták térfogatkapcsolatban az aktiválta K+ szabályozásában Cl– acetikolin csatorna). csatornák nyitása). receptor). Kapuzás II. A csatornák sok kapuzási állapotban lehetnek: pl. zárt,nyitott és inaktivált állapotban mint a feszültség kapuzott K+ csatornák. A Z és I nem-vezető, míg az O vezető állapotot jelent. Ny (O) ∆Em I 0.5 pA Z (C) O C +50 mV -120 mV 100 ms I Kapuzás III. Az aktivációért és inaktivációért felelős domain azonosítása egy pozitív töltéssel kevesebbet tartalmazó
feszültség szenzor feszültség szenzor aktiváció Nyitási valószínűség open probability 1.0 0.8 0.6 0.4 WT 0.2 R368Q 0.0 -100 -50 0 test potential (mV) 50 100 Membrán potenciál (mV) Kapuzás III. Az aktivációért és inaktivációért felelős domain azonosítása inaktiváció vad típusú K+ csatorna IM WT Deletion mutant ∆6-46 IM mutáns K+ csatorna Deletion mutant ∆6-46 +ball peptide 0 IM 50 100 µM 0 20 40 60 Time (ms) 80 Az ioncsatornák osztályozása szelektivitás alapján: Nagy szelektivitású csatornák, négy alegység K+, Na+, Ca2+, Cl- Kis szelektivitású csatornák, öt alegység: Acetil kolin receptor, csak kationokra specifikus Nem szelektív csatornák Gap junction csatorna (hat alegység) A szelektivitást biztosító mechanizmusok –– – –– 20' méret alapján: ami nem fér be az nem megy át! töltés alapján: ami nem megfelelő töltésű ion az nem mehet át! specifikus kölcsönhatás az
ionok és az aminosav oldalláncok között. Töltés alapján szelektál a nikotinerg acetilkolin receptor (ligand kapuzott ion csatorna) filter specifikus kölcsönhatások a pórus és az ionok között röntgen krisztallográfiás kép a pórusról szelektivitási filter (GYGD) a pórusban tartózkodó ionok ionok áthaladása a szelektivitási filteren A patch-clamp technika segítségével tanulmányozhatók az ionáramok kis sejteken is. voltage clamp (feszültség zár): a membránpotenciál (pipetta potenciál) konstans értéken tartása függetlenül a membrán áramok nagyságától és Rf irányától Vout Ip − + Vhold Sakmann, Nobel lecture, 1992, Neuron 8:613-629. Op. amp PATCH PIPETTA hő polírozást követően K+ áram (nA) cell attached patch 1.2 0.8 0.4 0.0 whole cell 0 500 1000 Idõ (ms) vákuum húzás C 1 pA O 100 ms outside out patch Membránpotenciál és elektromos ingerlékenység referencia elektróda az
extracelluláris oldatban mikroelektróda vezető oldattal töltve (KCl) Membránpotenciál (mV) axon membrán mikroelektróda bejuttatása az axonba nyugalmi potenciál idő plazmamembrán K+ csatorna RT p K [K]i + p Na [Na]i + p Cl [Cl] o dψ = E m = − ln Fz p K [K] o + p Na [Na] o + p Cl [Cl]i Na+ csatorna Cl− csatorna intracelluláris oldat extracelluláris oldat A nyugalmi membránpotenciált (Em) meghatározó tényezők: •Diffúziós potenciál, GHK egyenlet (Ediff) -koncentráció gradiens + szelektív permeábilitás -legfontosabb meghatározója az Em –nek •Pumpa potenciál (Vp) - Na+/K+ ATP-áz -2K+/3Na+ Æ elektrogén -sejttípustól függően: 2-16 mV (közvetlen hozzájárulás) -legnagyobb jelentősége az egyenlőtlen ionkoncentrációk fenntartása a membrán két oldala közöttÆ közvetve Ediff •Donnan potenciál - nem permeábilis protein anionok jelenléte a citoszol felől -elhanyagolható hozzájárulás az Em-hez , a sejtek többek
között a Donnan egyensúly kialakulása ellen is “küzdenek” hiperpolarizációdepolarizáció depolarizáció Egy adott sejttípus akciós potenciáljainak (AP) jellemzői: • Megfelelő inger hatására alakulnak ki • karakterisztikus, időfüggő membránpotenciál változások • Az egyes AP-k -amplitúdója -alakja -hosszúsága igen hasonló • az inger erőssége az AP-ok frekvenciájában kódolt. AP idő Membránpotenciál (mV) Az akciós potenciál jellemzői: felszálló szár: depolarizáció túllövés (overshoot) repolarizáció küszöb küszöb alatti ingerek stimulus erősség utó hiperpolarizáció Stimulus intenzitás-kihasználási idő összefüggés relatív intensitystimulus of stimulus intenzitás (relative) minimális stimulációs idő reobázis kronaxia duration of stimulus (ms) stimulus hosszúság (ms) abszolút (ARP) és relatív refrakter periódus (RRP) RRP Membránpotenciál (mV) ARP AP nyugalmi
potenciál Idő (ms) meghatározott koncentráció gradiens esetén Ediff –t Px határozza meg nyugalmi potenciál hiperpolarizáció depolarizáció membránpotenciál (mV) PNa ↑ 200 x PK ↓ 5x PK ↑ 200 x PCl ↑ 200 x nyugalmi potenciál Ediff számítása az egyszerűsített GHK egyenletből: PNa/PK a döntő [K]i = 140 mM [K]o = 5 mM [Na]i = 10 mM [Na]o = 140 mM T=37 oC Membránpotenciál (mV) 60 40 20 0 -20 PNa [K]i + [Na]i RT PK Em = − ln zF [K] + PNa [Na] o o PK -40 -60 -80 -100 1E-3 0.01 0.1 p Na /p k 1 10 Na+ és K+ permeabilitás változás az AP alatt membránpotenciál (mV) depolarizáció: ↑ hiperpolarizáció:↓ AP nyugalmi potenciál permeabilitás Idő (ms) Na+ permeabilitás K+ permeabilitás Idő (ms) az AP [Na+]o függésének bizonyítéka (Hodgkin and Katz, 1949) Idő (ms) Ionáramok mérése voltage-clamp technikával (Cole, Hodgkin, Huxley) Im= Ii + Ic = Ii + Cm dV/dt dV/dt=0 Æ Im= Ii “van ” érték
“kell ” érték negatív visszacsatolás Az ionáramok szeparácója gátlószerek segítségével membrán áram TTX Idő (ms) Az AP-ért felelős Na+ és K+ konduktanciák Em voltage clamp visszatérés nyugalmi potenciálra K+ konduktancia Na+ konduktancia nyugalmi potenciál idő (ms) Na+ csatorna nyitás ∆Em depolarizáció konduktancia további depolarizáció Na+ cs. inaktiváció K+ cs. késleltetett aktiváció K+ cs.záródás idő (ms) membránpotenciál (mV) PNa↑ még több Na+ csatorna nyitás Local circuit currents Scalar electrocardiography
[K+]i=140 mM + RT [K ] i EK = − ln + = E m = −89 mV zF [K ] o [K+]i=140 mM + RT [K ] i ∆Ψ K = − ln + = −89 mV zF [K ] o T= 37 oC, z=1 ∆ψm= – 60 mV I = G(Em–EK)= 0 I = G(Em–EK) ≠ 0 Az ioncsatornák hidrofil bélésű, az ionok számára kedvező fizikokémiai környezetű pórust képeznek a membránban. Két alapvető tulajdonsággal rendelkeznek e pórusok, melyek alapján a csatornák osztályozhatók. kapuzás = megfelelő “inger” hatására bekövetkező konformáció változás a fehérjében, mely a csatornák különböző állapotaihoz vezet (pl. zárt, nyitott , inaktivált állapotok). Szelektív permeabilitás = csak bizonyos fajta ion (vagy ionok) számára átjárható a pórus (pl. nagy szelektivitású, kis szelektivitású, és nem szelektív csatornák). Kapuzás I. A csatornák felosztása a nem vezető (zárt) és vezető (nyitott) állapot közötti átmenetet kiváltó inger alapján: feszültség kapuzott= a
membránpotenciál megváltozása az inger (pl. idegsejtek depolarizáció aktiválta K+ és Na+ csatornái). ligand kapuzott = i.c hírvivő molekula Membrán feszülés által kapuzott a ligand bekötő- által kapuzott = a dése az extracellu- ligand bekötődése (“stretch gated”) csatorna = a láris oldalon az intracelluláris membrán feszülése jelenti az ingert oldalon jelenti az jelenti az ingert (pl. (p.l ideg-izom ingert (pl a Ca2+ limfociták térfogatkapcsolatban az aktiválta K+ szabályozásában Cl– acetikolin csatorna). csatornák nyitása). receptor). Kapuzás II. A csatornák sok kapuzási állapotban lehetnek: pl. zárt,nyitott és inaktivált állapotban mint a feszültség kapuzott K+ csatornák. A Z és I nem-vezető, míg az O vezető állapotot jelent. Ny (O) ∆Em I 0.5 pA Z (C) O C +50 mV -120 mV 100 ms I Kapuzás III. Az aktivációért és inaktivációért felelős domain azonosítása egy pozitív töltéssel kevesebbet tartalmazó
feszültség szenzor feszültség szenzor aktiváció Nyitási valószínűség open probability 1.0 0.8 0.6 0.4 WT 0.2 R368Q 0.0 -100 -50 0 test potential (mV) 50 100 Membrán potenciál (mV) Kapuzás III. Az aktivációért és inaktivációért felelős domain azonosítása inaktiváció vad típusú K+ csatorna IM WT Deletion mutant ∆6-46 IM mutáns K+ csatorna Deletion mutant ∆6-46 +ball peptide 0 IM 50 100 µM 0 20 40 60 Time (ms) 80 Az ioncsatornák osztályozása szelektivitás alapján: Nagy szelektivitású csatornák, négy alegység K+, Na+, Ca2+, Cl- Kis szelektivitású csatornák, öt alegység: Acetil kolin receptor, csak kationokra specifikus Nem szelektív csatornák Gap junction csatorna (hat alegység) A szelektivitást biztosító mechanizmusok –– – –– 20' méret alapján: ami nem fér be az nem megy át! töltés alapján: ami nem megfelelő töltésű ion az nem mehet át! specifikus kölcsönhatás az
ionok és az aminosav oldalláncok között. Töltés alapján szelektál a nikotinerg acetilkolin receptor (ligand kapuzott ion csatorna) filter specifikus kölcsönhatások a pórus és az ionok között röntgen krisztallográfiás kép a pórusról szelektivitási filter (GYGD) a pórusban tartózkodó ionok ionok áthaladása a szelektivitási filteren A patch-clamp technika segítségével tanulmányozhatók az ionáramok kis sejteken is. voltage clamp (feszültség zár): a membránpotenciál (pipetta potenciál) konstans értéken tartása függetlenül a membrán áramok nagyságától és Rf irányától Vout Ip − + Vhold Sakmann, Nobel lecture, 1992, Neuron 8:613-629. Op. amp PATCH PIPETTA hő polírozást követően K+ áram (nA) cell attached patch 1.2 0.8 0.4 0.0 whole cell 0 500 1000 Idõ (ms) vákuum húzás C 1 pA O 100 ms outside out patch Membránpotenciál és elektromos ingerlékenység referencia elektróda az
extracelluláris oldatban mikroelektróda vezető oldattal töltve (KCl) Membránpotenciál (mV) axon membrán mikroelektróda bejuttatása az axonba nyugalmi potenciál idő plazmamembrán K+ csatorna RT p K [K]i + p Na [Na]i + p Cl [Cl] o dψ = E m = − ln Fz p K [K] o + p Na [Na] o + p Cl [Cl]i Na+ csatorna Cl− csatorna intracelluláris oldat extracelluláris oldat A nyugalmi membránpotenciált (Em) meghatározó tényezők: •Diffúziós potenciál, GHK egyenlet (Ediff) -koncentráció gradiens + szelektív permeábilitás -legfontosabb meghatározója az Em –nek •Pumpa potenciál (Vp) - Na+/K+ ATP-áz -2K+/3Na+ Æ elektrogén -sejttípustól függően: 2-16 mV (közvetlen hozzájárulás) -legnagyobb jelentősége az egyenlőtlen ionkoncentrációk fenntartása a membrán két oldala közöttÆ közvetve Ediff •Donnan potenciál - nem permeábilis protein anionok jelenléte a citoszol felől -elhanyagolható hozzájárulás az Em-hez , a sejtek többek
között a Donnan egyensúly kialakulása ellen is “küzdenek” hiperpolarizációdepolarizáció depolarizáció Egy adott sejttípus akciós potenciáljainak (AP) jellemzői: • Megfelelő inger hatására alakulnak ki • karakterisztikus, időfüggő membránpotenciál változások • Az egyes AP-k -amplitúdója -alakja -hosszúsága igen hasonló • az inger erőssége az AP-ok frekvenciájában kódolt. AP idő Membránpotenciál (mV) Az akciós potenciál jellemzői: felszálló szár: depolarizáció túllövés (overshoot) repolarizáció küszöb küszöb alatti ingerek stimulus erősség utó hiperpolarizáció Stimulus intenzitás-kihasználási idő összefüggés relatív intensitystimulus of stimulus intenzitás (relative) minimális stimulációs idő reobázis kronaxia duration of stimulus (ms) stimulus hosszúság (ms) abszolút (ARP) és relatív refrakter periódus (RRP) RRP Membránpotenciál (mV) ARP AP nyugalmi
potenciál Idő (ms) meghatározott koncentráció gradiens esetén Ediff –t Px határozza meg nyugalmi potenciál hiperpolarizáció depolarizáció membránpotenciál (mV) PNa ↑ 200 x PK ↓ 5x PK ↑ 200 x PCl ↑ 200 x nyugalmi potenciál Ediff számítása az egyszerűsített GHK egyenletből: PNa/PK a döntő [K]i = 140 mM [K]o = 5 mM [Na]i = 10 mM [Na]o = 140 mM T=37 oC Membránpotenciál (mV) 60 40 20 0 -20 PNa [K]i + [Na]i RT PK Em = − ln zF [K] + PNa [Na] o o PK -40 -60 -80 -100 1E-3 0.01 0.1 p Na /p k 1 10 Na+ és K+ permeabilitás változás az AP alatt membránpotenciál (mV) depolarizáció: ↑ hiperpolarizáció:↓ AP nyugalmi potenciál permeabilitás Idő (ms) Na+ permeabilitás K+ permeabilitás Idő (ms) az AP [Na+]o függésének bizonyítéka (Hodgkin and Katz, 1949) Idő (ms) Ionáramok mérése voltage-clamp technikával (Cole, Hodgkin, Huxley) Im= Ii + Ic = Ii + Cm dV/dt dV/dt=0 Æ Im= Ii “van ” érték
“kell ” érték negatív visszacsatolás Az ionáramok szeparácója gátlószerek segítségével membrán áram TTX Idő (ms) Az AP-ért felelős Na+ és K+ konduktanciák Em voltage clamp visszatérés nyugalmi potenciálra K+ konduktancia Na+ konduktancia nyugalmi potenciál idő (ms) Na+ csatorna nyitás ∆Em depolarizáció konduktancia további depolarizáció Na+ cs. inaktiváció K+ cs. késleltetett aktiváció K+ cs.záródás idő (ms) membránpotenciál (mV) PNa↑ még több Na+ csatorna nyitás Local circuit currents Scalar electrocardiography




 Just like you draw up a plan when you’re going to war, building a house, or even going on vacation, you need to draw up a plan for your business. This tutorial will help you to clearly see where you are and make it possible to understand where you’re going.
Just like you draw up a plan when you’re going to war, building a house, or even going on vacation, you need to draw up a plan for your business. This tutorial will help you to clearly see where you are and make it possible to understand where you’re going.