Please log in to read this in our online viewer!
Please log in to read this in our online viewer!
No comments yet. You can be the first!
What did others read after this?
Content extract
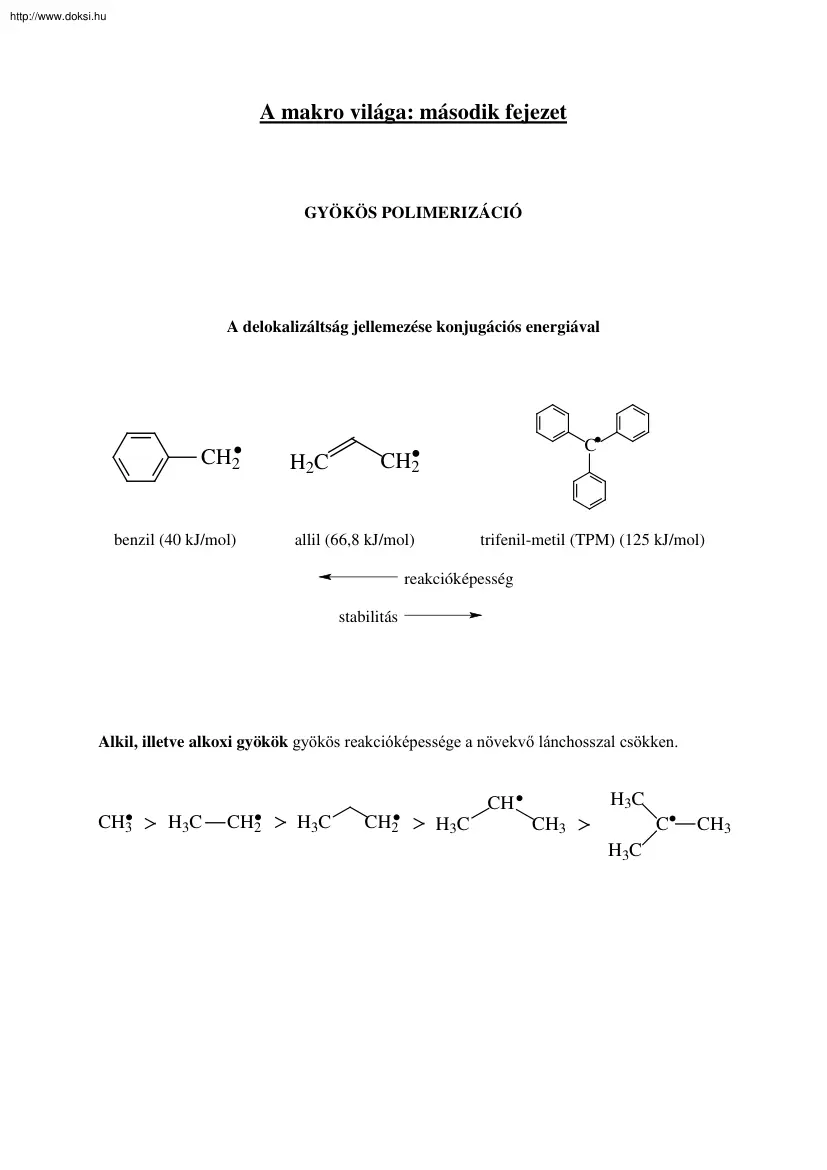
http://www.doksihu A makro világa: második fejezet GYÖKÖS POLIMERIZÁCIÓ A delokalizáltság jellemezése konjugációs energiával CH2 benzil (40 kJ/mol) H2C C CH2 allil (66,8 kJ/mol) trifenil-metil (TPM) (125 kJ/mol) reakcióképesség stabilitás Alkil, illetve alkoxi gyökök gyökös reakcióképessége a növekvő lánchosszal csökken. H 3C CH CH3 H3C CH2 H3C CH2 H 3C C CH3 H 3C CH3 http://www.doksihu GYÖKÖS POLIMERIZÁCIÓ Stabilis szabad gyökök: TPM (trifenil-metil gyök): . C DPPH: . NO2 N N NO2 NO2 Banfield gyök: CH3 CH3 CH3 . C CH2 C N O N O GYÖKÖS POLIMERIZÁCIÓ http://www.doksihu Egy szabad gyök legfontosabb reakciói a következők: - addíció telítetlen kötésre (propagáció, láncátadás, inhibició), - szubsztitúció (láncátadás, inhibició), - reakció másik szabad gyökkel (lánczáródás), - bomlási reakció (depolimerizáció), - izomerizáció (dezaktiválódás átrendezéssel).
A szabad gyökök élettartama az eltűnéshez vezető reakciók sebességi állandójával fordítva arányos. τ≈ 1 ≈ 10 −6 − 10 −10 [s] k http://www.doksihu A GYÖKÖS POLIMERIZÁCIÓ ELEMI LÉPÉSEI 1. Iniciálás (initiation): I R• ki 2. Láncnövekedés (chain propagation): R• + M P1• k p1 P1• + M P2• kp2 Pi • + M Pi +•1 k pi 3. Lánczáródás (chain termination): Pi + j Pi + Pj kt ,r kt ,d Pi • + X Pi + X • ktr • • Pi + Pj 4. Láncátadás (chain transfer): 5. Inhibíció, retardálás (inhibition, retardation): • Pi + Z Ahol Pi + Z • Pi Z • kinh I , M , X, Z, Pi : iniciátor, monomer, láncátadószer, inhibitor (retarder), polimer molekula, R• , Pi • , X • , Z • : szabad gyökök. http://www.doksihu Molekulatömeg v áltozás Molekulatömeg v áltozás Molekulatömeg v áltozás A MOLEKULATÖMEG VÁLTOZÁSA AZ ÁTALAKULÁSSAL 0 20 40 60 Konv erzió (%) a., 80 100 0 20 40 60
Konv erzió (%) b., 80 100 0 20 40 60 Konv erzió (%) c., a. Polimerizációs láncreakció; b. Lépéses polimerizáció; c. Meghatározatlan ionos polimerizációs láncreakció és protein szintézis (élőpolimerizáció) 80 100 http://www.doksihu GYÖKÖS INICIÁLÁS Az iniciátor bomlás lehet termikus vagy fotokémiai: I 2 fR• kb A bomlás sebessége: − dI = kb I dt A gyökképződés sebessége: dR • = 2 k b fI dt Maga az iniciálás gyors: R• + M P1• (= RM • ) A sebesség-meghatározó lépés a lassú iniciátorbomlás: dR• = ki I vi = dt ( ki = 2 kb f ) f az ún. gyökhasznosítási tényező: a képződő gyököknek az a hányada, amely rekombináció nélkül kijön az oldószer kalitkából (kalitka-effektus.) Az f definíciójából következik, hogy f ≤ 1. PEROXI-TÍPUSÚ INICIÁTOROK http://www.doksihu Hidroperoxidok: bomlási hőmérséklet 100-150oC t-Butil-hidroperoxid: CH3 CH3 C CH3 O OH CH3 CH3 C . O + OH
CH3 O CH3 C . CH3 + CH3 Kumil-hidroperoxid: CH3 C CH3 CH3 O OH C . O + OH CH3 CH3 C . O + CH3 http://www.doksihu PEROXI-TÍPUSÚ INICIÁTOROK Dialkil és diaril peroxidok: bomlási hőmérséklet 100 °C felett. Dibenzoil-peroxid: O C O O O C . O 2 C O . + CO2 CCl 4 -oldószerben 96 % CO 2 keletkezik. Mozgékony (reaktív) hidrogén atomot tartalmazó közegben a következő folyamat játszódik le: O C . O + RH O C . +R OH benzoesav http://www.doksihu PEROXI-TÍPUSÚ INICIÁTOROK Fontos peroxidok még a di-t-butil-peroxid és a di-kumil-peroxid. CH3 CH3 C CH3 O O CH3 C CH3 CH3 2 CH3 C CH3 O CH3 di-t-butil-peroxid O CH3 CH3 C CH3 C CH3 CH3 O O C CH3 + CH3 C 2 O CH3 CH3 di-kumil-peroxid O C CH3 + CH3 http://www.doksihu PEROXI-TÍPUSÚ INICIÁTOROK Peroxi-dikarbonátok: bomlási hőmérséklet 30 °C körül. RO C C O O O OR 2 RO + 2 CO2 O R: etil, izopropil, stb. Vizes közegben (emulziós
polimerizációhoz) használható iniciátorok a következők: Hidrogén peroxid: H 2 O 2 2 • OH ( ) Perszulfátok K ⊕ , NH ⊕ 4 : O K(O3S O O SO3)K 2 . O O S OK http://www.doksihu AZO INICIÁTOROK Az azo iniciátorokból nitrogénvesztés közben gyökök képződnek: R − N = N − R 2R • + N 2 Az egyik leggyakrabban alkalmazott gyökös iniciátor az azo-bisz-izo-butironitril (AIBN): 50 o C körül bomlik. CH3 CH3 C N N C CH3 2 CH3 C + N2 CN CN CN . CH3 CH3 (Primer rekombináció miatt f ≈ 0,6 - 0,8 ) DIAZO INICIÁTOROK Diazo-amino-benzol 100 oC körül: N N . NH + . NH + N2 Diazo-észter és diazo-tio-észter: O N N O C O R N N S C R http://www.doksihu NÉHÁNY INICIÁTOR FELEZÉSI IDEJE Felezési idő Iniciátor AIBN 50 oC 60 oC 70 oC 85 oC 100 oC 74 h Benzoil-peroxid 4,8 h 7,2 min 7,3 h 1,4 h 19,8 115 130 o C o 1,9 h 18 145 oC C 155 176 o o C C min Acetil-peroxid 158 h Lauril-peroxid 47,7
12,8 h h Butil-peroxid 8,1 h 1,1 h 3,5 h 30 min 88 h 2,5 h min Kumil-peroxid 13 h 1,7 h 16,8 min t-Butil-peroxid 218 h t-Butil-hidroperoxid 338 h 34 h 6,4 h 1,38 h 44,9 4,81 h h A felezési idők az iniciátorok benzolos vagy toluolos oldatára érvényesek. http://www.doksihu REDOX RENDSZEREK Az iniciálás olyan redox rendszerrel is végbemehet, ahol változó vegyértékű fém (Me) és karbonsav lép reakcióba: O R C O + OH- R C OH Men+ Me(n+1)+ O O R C R C OH + H+ O Termikus és fotoiniciálás iniciátor nélkül Sztirol termikus "öniniciálásának" valószínű mechanizmusa a következő: 2 CH2 CH . . CH CH2 CH2 CH http://www.doksihu Fotoiniciálás CCl 4 jelenlétében: CH2 CH hv CH2 CH X CCl4 Cl CH2 . CH + CCl3 X X REDOX RENDSZEREK Láncnövekedés k p1 ≈ k p 2 ≈ k p 3 =. = k pi = k p Legvalószínűbb a fej-láb kapcsolódás: . ~ CH2 CH + CH2 CH X X Diénpolimerizációnál allil-gyök képződik: kp
. ~ CH2 CH CH2 CH X X http://www.doksihu . R + CH2 CH CH CH2 R R CH2 CH CH CH2 1,2 . 1,4 CH2 CH CH CH2 R CH2 CH CH . CH2 http://www.doksihu REDOX RENDSZEREK Lánczáródás A lánczáródás történhet a gyökök rekombinációjával (pl. PS, PAN) i ~ CH2 . j i+j CH + CH CH2~ X k t,r ~ CH2 X CH CH CH2~ X X vagy diszproporcionálódással (pl. PVAc): i . j i ~ CH2 CH + CH CH2~ X k t,d j ~ CH CH + CH2 CH2~ X X X A diszproporcionálódás és a rekombináció sebességi állandóinak aránya: kt ,d kt ,r 40 oC 0,49 60 oC 0,75 80 oC 1,27 k t,d : a diszproporcionálódással történő termináció és k t,r : a rekombinációval történő termináció sebességi állandója. http://www.doksihu REDOX RENDSZEREK Láncátadás: Oldószerre (HY): ~ CH2 . CH + HY k tr,s ~ CH2 . CH2 + Y X X A polimerizáció (a kinetikai lánc) megy tovább: Y• + M Y - M • Monomerre: ~ CH2 . CH + CH2 CH X X . CH CH2 ~
CH2 . k tr, 1 CH2 + CH2 C . X X ~ CH kp X X ~ CH2 CH CH + CH3 CH X X k tr, 2 http://www.doksihu REDOX RENDSZEREK Vinil-acetát esetén például a következő folyamat játszódik le: ~ CH2 . CH + OC CH3 CH2 CH OC k tr, 3 ~ CH2 CH3 CH2 + CH2 CH OC OC O O O CH3 . CH2 O Láncátadó konstansok: CM = ktr , M kp Ahol k tr,M a sebességi állandó, k tr a láncátadás sebességi állandója és k p a láncnövekedés sebességi állandója. C M értékek néhány monomerre Monomer Akril-amid Akril-nitril Etilén Metil-akrilát Metil-metakrilát Sztirol Vinil-acetát Vinil-klorid C M x104 0,6-0,12b 0,26-0,3 0,4-4,2 0,036-0,325 0,07-0,25 0,30-0,60 1,75-2,8 10,8-16 Minden C M 60 oC-ra vonatkozik, a kivétel jelölve van b C M 40 oC-on http://www.doksihu REDOX RENDSZEREK Láncátadás Polimerre: ~ CH2 . CH + ~ CH2 CH~ X X k tr, p CH2 + ~ CH2 . X X Iniciátorra: . ~ CH2 CH + R R k tr,i X ~ CH2 . ~ CH2 CH R
+ R X Inhibítorra: ~ CH2 . CH + HZ X k inh ~ CH2 . CH2 + Z X C~ http://www.doksihu INICIÁTOR LÁNCÁTADÓ KONSTANSOK (C I ) C I polimerizációjára Iniciátor 2,2 -Azo-bisz-butiro-nitril Sztirol 0,091-0,14 Metil-metakrilát 0,02 Akrilamid - 0,00076-0,00092 - - Kumil-peroxid (50 oC) 0,01 - - Lauroil-peroxid (70oC) 0,024 - - 0,048-0,10 0,02 - t-Butil-hidroperoxid 0,035 - - Kumil-hidroperoxid 0,063 0,33 - Perszulfát (40 oC) - - 0,0026 ′ t-Butil-peroxid Benzoil-peroxid C I értékek 60 oC-ra vonatkoznak, az ettől eltérő hőmérséklet jelölve van. A kinetikai lánchossz definíció szerint: Míg a polimerizáció fok: Pn = ν= propagáció valószínűsége termináció valószínűsége propagáció valószínűsége termináció + transzfer valószínűsége A kinetikai lánchossz és a polimerizáció fok között az összefüggés a következő: ν ≥ Pn http://www.doksihu ÁTADÓ KONSTANSOK LÁNCÁTADÓ ANYAGOKRA
Átadó anyag Benzol Ciklohexán Heptán Toluol Etil-benzol Izopropil-benzol t-Butil-benzol n-Butil-klorid n-Butil-bromid 2-Klór-bután Aceton Ecetsav n-Butanol Etil-éter Kloroform n-Butil-jodid Butil-amin Trietil-amin Di-n-butil-szulfid Di-n-butil-diszulfid Széntetraklorid Széntetrabromid n-Butil-merkaptán C s x104 Sztirol 0,023 0,031 0,42 0,125 0,67 0,82 0,06 0,04 0,06 1,2 4,1 2,0 1,6 5,6 3,4 1,85 7,0 7,1 22 24 110 22 000 210 000 Vinil-acetát 1,2 7,0 17,0 (50 oC) 21,6 55,2 89,9 3,6 10 50 11,7 1,1 20 45,3 150 800 370 260 10 000 10 700 390 000 480 000 A C s értékek 60 oC-ra vonatkoznak, az ettől eltérő hőmérséklet jelölve van. http://www.doksihu POLÁRIS HATÁSOK A LÁNCÁTADÁSBAN Láncátadó anyag Monomer CCl 4 (C 2 H 5 ) 3 N C s x104 k tr C s x104 k tr Vinil-acetát 10 700 2400 370 85 Akril-nitril 0,85 0,17 3800 760 Metil-akrilát 1,25 (80 oC) 0,26 (80 oC) 400 84 Metil-metakrilát 2,4 0,12 1900 98 Sztirol 110 1,8 7,1 0,12 A C s
értékek 60 oC-ra vonatkoznak, az ettől eltérő hőmérséklet jelölve van. http://www.doksihu TELOMERIZÁCIÓ Telomerizáció: az a folyamat, amelyből a végcsoport (telos = vég) kialakítása láncátadással történik. Ennek lépései: - iniciálás (a primer gyök átalakítása A funkcióvá): R • + AB RB + A • - láncnövekedés A • + M AM • AM n M • AM n +1 M • - láncátadás (a láncvég kialakítása B funkcióvá): AM n M • + AB A - M n +1 - B + A • Ipari példa az etilén polimerizációja széntetraklorid jelenlétében: R • + CCl 4 RCl + • CCl 3 • Cl 3C - (CH 2 - CH 2 )n - CH 2 - C H 2 + CCl 4 Cl 3C - (CH 2 - CH 2 )n +1 - Cl + • CCl 3 http://www.doksihu INHIBÍCIÓ, RETARDÁLÁS A folyamatok lejátszódhatnak - addíciós mechanizmus szerint: R • + Z RZ • vagy R • + Z • RZ - és szubsztitúciós mechanizmus szerint: R • + HZ RH + Z• Az inhibíciót az indukciós periódussal tudjuk jellemezni: t ind
= µ ⋅ Cinh vi ahol µ: sztöchimetriai koefficiens, melynek értéke elvileg 1 vagy 2, gyakorlatilag azonban 0 < µ ≤ 2; C inh inhibitor koncentrációja; v i : az inhibíció sebessége. http://www.doksihu INHIBÍCIÓ, RETARDÁLÁS Inhibitorok vagy retarderek lehetnek: vegyérték telített molekulák: kinonok: . . RO . R+O O O . O R RO OR O R O O . R R + HO R O R R HO OR Aromás nitro-vegyületek: . O - R+ + N RO . Ar N Ar . R ROR + ArN O O O Kondenzált-gyűrűs aromás vegyületek: . R + R . CH R R R http://www.doksihu INHIBÍCIÓ, RETARDÁLÁS Inhibitorok vagy retarderek lehetnek: Stabilizált szabad gyökök: 1. TPM, DPPH, Banfield-gyök (rekombináció játszódik le) 2. Az O 2 is szabad gyök (biradikális, iniciálni is tud!) 3. Változó vegyületű fémek, pl Fe A vas az egyik leggyakrabban használt szerkezeti anyag – jelenlétével és szennyezésével is gyakran számolni kell.
Autoinhibíció . ~ CH2 CH CH2 CH . láncnöv. CH2X CH2X ~ CH2 CH + CH2 CH CH2X CH2X izomerizáció ~ CH2 CH2 . CH X láncátadás ~ CH2 CH2 + CH2 CH CH2X . CHX http://www.doksihu A GYÖKÖS POLIMERIZÁCIÓ KINETIKÁJA A polimerizációs folyamat a következő: I 2R• kb R• + M P1• Pn• + M Pn•+1 kP Pi • + Pj• polimer kt Iniciátor bomlásra a sebességi egyenlet: − dI = kb I dt Gyökképződésre, iniciálásra az alábbi összefüggés írható fel: dR • = k i I = 2k b f I vi = dt f: gyökhasznosítási tényező. ν i : az iniciálás sebessége Propagációra, monomer-fogyásra: vp = − dm = kpr m dt (r = R + ∑ P ) • ν p : a láncnövekedés sebessége A gyökkoncentráció változása az előbbiek felhasználásával: dr = vi − k t r 2 dt • i http://www.doksihu A GYÖKÖS POLIMERIZÁCIÓ KINETIKÁJA A stacionárius állapot (steady state) miatt dr dm r nem konstans, de << dt dt
dr ≈0 dt vi = k t rst2 rst = vi = kt 2k b f ⋅ I kt A stacionárius gyökkoncentrációval a láncnövekedési folyamat sebessége: v p = k p rst m = k p dI - Ha I = I 0 (= konstans), dt << 2k b f kt I ⋅m = K I ⋅m dm : dt a propagáció sebessége: vp = − dm dm = K I0 ⋅ m = − K I 0 dt dt m a differenciál - egyenlet megoldása: ln m0 = K I0 ⋅ t m ahol K I 0 a polimerizáció bruttó sebességi állandója. http://www.doksihu A GYÖKÖS POLIMERIZÁCIÓ KINETIKÁJA - Ha I nem konstans, akkor − dI = k b I I = I 0 e − kb t dt behelyettesitve k t − b dm − = K I0 e 2 ⋅ m dt Ebből k t − b m0 2 k I 0 ln = 1 − e 2 m kb ahol I o az iniciátor kezdeti koncentrációja. Az iniciátor elfogyása utáni határkonverzió („dead-end”) a következő: m0 2 K I 0 ln = m∞ kb http://www.doksihu A GYÖKÖS POLIMERIZÁCIÓ KINETIKÁJA A polimerizáció
sebessége (R p ) és az iniciátor koncentráció négyzetgyöke (I1/2) közötti összefüggés 24 22 20 Rp *106, (mol/l-sec) 18 16 14 12 10 8 6 4 2 0 0,00 0,05 0,10 0,15 0,20 0,25 1/2 [I] , (mol/l) ♦= Metil-metakrilát, benzoil-peroxid, 50 oC =Vinil-benzolát, azo-bisz-izo-butironitril, 60 oC 0,30 http://www.doksihu A GYÖKÖS POLIMERIZÁCIÓ KINETIKÁJA A polimerizáció aktiválási energiája: E = Ep + ahol: 1 1 Eb − Et 2 2 1 E p − Et : a monomerre jellemző ≈15-25 kJ/mol. 2 Eb : az iniciálás módjától, illetve az iniciátortól függ: termikus iniciálásnál ≈ 120-180 kJ/mol A kp redox-rendszernél ≈ 40-60 kJ/mol foto-iniciálásnál ≈ 0 kJ/mol. kt kifejezés értéke a monomertől függ: minél reakcióképesebb a monomerből képződött gyök, annál nagyobb k p kt . Például néhány monomerre a sorrend: VAc > VC > MMA > S (a monomerek reaktivitása fordított sorrendben változik) http://www.doksihu A GYÖKÖK
HOSSZÚSÁG SZERINTI ELOSZLÁSA A különböző gyökök koncentrációjának időbeli változása: dr1 = vi − k p r1 m − k t r1 r dt dr2 = k p r1 m − k p r2 m − k t r2 r dt dri = k p ri −1 m − k p ri m − k t ri r dt dr ∑ : dt = νi − k t (r1 + r2 + . + ri )r = νi − k t r 2 ≈ 0 Rekurzió van, tehát ri = ahol kpm k p m + kt r ⋅ rr −1 = α ⋅ ri −1 α = a láncnövekedés valószínűsége, 1-α = a lánczáródás valószínűsége. Ennek alapján: r1 = νi k p m + kt r = kt r ⋅ r = (1 − α ) ⋅ r k p m + kt r tehát az eloszlás-függvény: ri = (1 − α )α i −1 r Ez geometriai eloszlás. http://www.doksihu A POLIMEREK HOSSZÚSÁG SZERINTI ELOSZLÁSA Diszproporcionálódás esetén a gyökök eloszlása „befagy”: k t , d rP r NP = ∞ ∑k t ,d = rP r rP = (1 − α )α P −1 r P= 1 ahol N p a P polimerizáció fokú részecskék száma. Ez az ún. legvalószínűbb („most probable”), vagy
„Flory”-eloszlás Rekombináció esetén: P −1 Np = ∑k ⋅r ⋅r t ,r P −i i i =1 ∞ P −1 ∑∑ k ⋅ r ⋅ r t ,r P −i i P = 2 i =1 P −1 ∑ (1 − α ) α α 2 i −1 P − i −1 i =1 P −1 = (1 − α ) ∑α P −2 = (1 − α ) (P − 1)α P −2 2 2 i =1 ∞ ∑ (1 − α ) (P − 1)α 2 P−2 ∞ ∞ = (1 − α ) ⋅ 2 P=2 1 =1 (1 − α )2 mert ∞ ∞ d x (α ) = d ∑ α x = dx x =1 P=2 x =1 x =1 dx d [α (1 + α + α 2 + .)] = d α = 1 − α + α2 = 1 2 = dα dα 1 − α (1 − α ) (1 − α ) ∑ (P − 1)α P−2 = ∑ xα x −1 = ∑ Így N p = (1 − α ) (P − 1)α P −2 2
A szabad gyökök élettartama az eltűnéshez vezető reakciók sebességi állandójával fordítva arányos. τ≈ 1 ≈ 10 −6 − 10 −10 [s] k http://www.doksihu A GYÖKÖS POLIMERIZÁCIÓ ELEMI LÉPÉSEI 1. Iniciálás (initiation): I R• ki 2. Láncnövekedés (chain propagation): R• + M P1• k p1 P1• + M P2• kp2 Pi • + M Pi +•1 k pi 3. Lánczáródás (chain termination): Pi + j Pi + Pj kt ,r kt ,d Pi • + X Pi + X • ktr • • Pi + Pj 4. Láncátadás (chain transfer): 5. Inhibíció, retardálás (inhibition, retardation): • Pi + Z Ahol Pi + Z • Pi Z • kinh I , M , X, Z, Pi : iniciátor, monomer, láncátadószer, inhibitor (retarder), polimer molekula, R• , Pi • , X • , Z • : szabad gyökök. http://www.doksihu Molekulatömeg v áltozás Molekulatömeg v áltozás Molekulatömeg v áltozás A MOLEKULATÖMEG VÁLTOZÁSA AZ ÁTALAKULÁSSAL 0 20 40 60 Konv erzió (%) a., 80 100 0 20 40 60
Konv erzió (%) b., 80 100 0 20 40 60 Konv erzió (%) c., a. Polimerizációs láncreakció; b. Lépéses polimerizáció; c. Meghatározatlan ionos polimerizációs láncreakció és protein szintézis (élőpolimerizáció) 80 100 http://www.doksihu GYÖKÖS INICIÁLÁS Az iniciátor bomlás lehet termikus vagy fotokémiai: I 2 fR• kb A bomlás sebessége: − dI = kb I dt A gyökképződés sebessége: dR • = 2 k b fI dt Maga az iniciálás gyors: R• + M P1• (= RM • ) A sebesség-meghatározó lépés a lassú iniciátorbomlás: dR• = ki I vi = dt ( ki = 2 kb f ) f az ún. gyökhasznosítási tényező: a képződő gyököknek az a hányada, amely rekombináció nélkül kijön az oldószer kalitkából (kalitka-effektus.) Az f definíciójából következik, hogy f ≤ 1. PEROXI-TÍPUSÚ INICIÁTOROK http://www.doksihu Hidroperoxidok: bomlási hőmérséklet 100-150oC t-Butil-hidroperoxid: CH3 CH3 C CH3 O OH CH3 CH3 C . O + OH
CH3 O CH3 C . CH3 + CH3 Kumil-hidroperoxid: CH3 C CH3 CH3 O OH C . O + OH CH3 CH3 C . O + CH3 http://www.doksihu PEROXI-TÍPUSÚ INICIÁTOROK Dialkil és diaril peroxidok: bomlási hőmérséklet 100 °C felett. Dibenzoil-peroxid: O C O O O C . O 2 C O . + CO2 CCl 4 -oldószerben 96 % CO 2 keletkezik. Mozgékony (reaktív) hidrogén atomot tartalmazó közegben a következő folyamat játszódik le: O C . O + RH O C . +R OH benzoesav http://www.doksihu PEROXI-TÍPUSÚ INICIÁTOROK Fontos peroxidok még a di-t-butil-peroxid és a di-kumil-peroxid. CH3 CH3 C CH3 O O CH3 C CH3 CH3 2 CH3 C CH3 O CH3 di-t-butil-peroxid O CH3 CH3 C CH3 C CH3 CH3 O O C CH3 + CH3 C 2 O CH3 CH3 di-kumil-peroxid O C CH3 + CH3 http://www.doksihu PEROXI-TÍPUSÚ INICIÁTOROK Peroxi-dikarbonátok: bomlási hőmérséklet 30 °C körül. RO C C O O O OR 2 RO + 2 CO2 O R: etil, izopropil, stb. Vizes közegben (emulziós
polimerizációhoz) használható iniciátorok a következők: Hidrogén peroxid: H 2 O 2 2 • OH ( ) Perszulfátok K ⊕ , NH ⊕ 4 : O K(O3S O O SO3)K 2 . O O S OK http://www.doksihu AZO INICIÁTOROK Az azo iniciátorokból nitrogénvesztés közben gyökök képződnek: R − N = N − R 2R • + N 2 Az egyik leggyakrabban alkalmazott gyökös iniciátor az azo-bisz-izo-butironitril (AIBN): 50 o C körül bomlik. CH3 CH3 C N N C CH3 2 CH3 C + N2 CN CN CN . CH3 CH3 (Primer rekombináció miatt f ≈ 0,6 - 0,8 ) DIAZO INICIÁTOROK Diazo-amino-benzol 100 oC körül: N N . NH + . NH + N2 Diazo-észter és diazo-tio-észter: O N N O C O R N N S C R http://www.doksihu NÉHÁNY INICIÁTOR FELEZÉSI IDEJE Felezési idő Iniciátor AIBN 50 oC 60 oC 70 oC 85 oC 100 oC 74 h Benzoil-peroxid 4,8 h 7,2 min 7,3 h 1,4 h 19,8 115 130 o C o 1,9 h 18 145 oC C 155 176 o o C C min Acetil-peroxid 158 h Lauril-peroxid 47,7
12,8 h h Butil-peroxid 8,1 h 1,1 h 3,5 h 30 min 88 h 2,5 h min Kumil-peroxid 13 h 1,7 h 16,8 min t-Butil-peroxid 218 h t-Butil-hidroperoxid 338 h 34 h 6,4 h 1,38 h 44,9 4,81 h h A felezési idők az iniciátorok benzolos vagy toluolos oldatára érvényesek. http://www.doksihu REDOX RENDSZEREK Az iniciálás olyan redox rendszerrel is végbemehet, ahol változó vegyértékű fém (Me) és karbonsav lép reakcióba: O R C O + OH- R C OH Men+ Me(n+1)+ O O R C R C OH + H+ O Termikus és fotoiniciálás iniciátor nélkül Sztirol termikus "öniniciálásának" valószínű mechanizmusa a következő: 2 CH2 CH . . CH CH2 CH2 CH http://www.doksihu Fotoiniciálás CCl 4 jelenlétében: CH2 CH hv CH2 CH X CCl4 Cl CH2 . CH + CCl3 X X REDOX RENDSZEREK Láncnövekedés k p1 ≈ k p 2 ≈ k p 3 =. = k pi = k p Legvalószínűbb a fej-láb kapcsolódás: . ~ CH2 CH + CH2 CH X X Diénpolimerizációnál allil-gyök képződik: kp
. ~ CH2 CH CH2 CH X X http://www.doksihu . R + CH2 CH CH CH2 R R CH2 CH CH CH2 1,2 . 1,4 CH2 CH CH CH2 R CH2 CH CH . CH2 http://www.doksihu REDOX RENDSZEREK Lánczáródás A lánczáródás történhet a gyökök rekombinációjával (pl. PS, PAN) i ~ CH2 . j i+j CH + CH CH2~ X k t,r ~ CH2 X CH CH CH2~ X X vagy diszproporcionálódással (pl. PVAc): i . j i ~ CH2 CH + CH CH2~ X k t,d j ~ CH CH + CH2 CH2~ X X X A diszproporcionálódás és a rekombináció sebességi állandóinak aránya: kt ,d kt ,r 40 oC 0,49 60 oC 0,75 80 oC 1,27 k t,d : a diszproporcionálódással történő termináció és k t,r : a rekombinációval történő termináció sebességi állandója. http://www.doksihu REDOX RENDSZEREK Láncátadás: Oldószerre (HY): ~ CH2 . CH + HY k tr,s ~ CH2 . CH2 + Y X X A polimerizáció (a kinetikai lánc) megy tovább: Y• + M Y - M • Monomerre: ~ CH2 . CH + CH2 CH X X . CH CH2 ~
CH2 . k tr, 1 CH2 + CH2 C . X X ~ CH kp X X ~ CH2 CH CH + CH3 CH X X k tr, 2 http://www.doksihu REDOX RENDSZEREK Vinil-acetát esetén például a következő folyamat játszódik le: ~ CH2 . CH + OC CH3 CH2 CH OC k tr, 3 ~ CH2 CH3 CH2 + CH2 CH OC OC O O O CH3 . CH2 O Láncátadó konstansok: CM = ktr , M kp Ahol k tr,M a sebességi állandó, k tr a láncátadás sebességi állandója és k p a láncnövekedés sebességi állandója. C M értékek néhány monomerre Monomer Akril-amid Akril-nitril Etilén Metil-akrilát Metil-metakrilát Sztirol Vinil-acetát Vinil-klorid C M x104 0,6-0,12b 0,26-0,3 0,4-4,2 0,036-0,325 0,07-0,25 0,30-0,60 1,75-2,8 10,8-16 Minden C M 60 oC-ra vonatkozik, a kivétel jelölve van b C M 40 oC-on http://www.doksihu REDOX RENDSZEREK Láncátadás Polimerre: ~ CH2 . CH + ~ CH2 CH~ X X k tr, p CH2 + ~ CH2 . X X Iniciátorra: . ~ CH2 CH + R R k tr,i X ~ CH2 . ~ CH2 CH R
+ R X Inhibítorra: ~ CH2 . CH + HZ X k inh ~ CH2 . CH2 + Z X C~ http://www.doksihu INICIÁTOR LÁNCÁTADÓ KONSTANSOK (C I ) C I polimerizációjára Iniciátor 2,2 -Azo-bisz-butiro-nitril Sztirol 0,091-0,14 Metil-metakrilát 0,02 Akrilamid - 0,00076-0,00092 - - Kumil-peroxid (50 oC) 0,01 - - Lauroil-peroxid (70oC) 0,024 - - 0,048-0,10 0,02 - t-Butil-hidroperoxid 0,035 - - Kumil-hidroperoxid 0,063 0,33 - Perszulfát (40 oC) - - 0,0026 ′ t-Butil-peroxid Benzoil-peroxid C I értékek 60 oC-ra vonatkoznak, az ettől eltérő hőmérséklet jelölve van. A kinetikai lánchossz definíció szerint: Míg a polimerizáció fok: Pn = ν= propagáció valószínűsége termináció valószínűsége propagáció valószínűsége termináció + transzfer valószínűsége A kinetikai lánchossz és a polimerizáció fok között az összefüggés a következő: ν ≥ Pn http://www.doksihu ÁTADÓ KONSTANSOK LÁNCÁTADÓ ANYAGOKRA
Átadó anyag Benzol Ciklohexán Heptán Toluol Etil-benzol Izopropil-benzol t-Butil-benzol n-Butil-klorid n-Butil-bromid 2-Klór-bután Aceton Ecetsav n-Butanol Etil-éter Kloroform n-Butil-jodid Butil-amin Trietil-amin Di-n-butil-szulfid Di-n-butil-diszulfid Széntetraklorid Széntetrabromid n-Butil-merkaptán C s x104 Sztirol 0,023 0,031 0,42 0,125 0,67 0,82 0,06 0,04 0,06 1,2 4,1 2,0 1,6 5,6 3,4 1,85 7,0 7,1 22 24 110 22 000 210 000 Vinil-acetát 1,2 7,0 17,0 (50 oC) 21,6 55,2 89,9 3,6 10 50 11,7 1,1 20 45,3 150 800 370 260 10 000 10 700 390 000 480 000 A C s értékek 60 oC-ra vonatkoznak, az ettől eltérő hőmérséklet jelölve van. http://www.doksihu POLÁRIS HATÁSOK A LÁNCÁTADÁSBAN Láncátadó anyag Monomer CCl 4 (C 2 H 5 ) 3 N C s x104 k tr C s x104 k tr Vinil-acetát 10 700 2400 370 85 Akril-nitril 0,85 0,17 3800 760 Metil-akrilát 1,25 (80 oC) 0,26 (80 oC) 400 84 Metil-metakrilát 2,4 0,12 1900 98 Sztirol 110 1,8 7,1 0,12 A C s
értékek 60 oC-ra vonatkoznak, az ettől eltérő hőmérséklet jelölve van. http://www.doksihu TELOMERIZÁCIÓ Telomerizáció: az a folyamat, amelyből a végcsoport (telos = vég) kialakítása láncátadással történik. Ennek lépései: - iniciálás (a primer gyök átalakítása A funkcióvá): R • + AB RB + A • - láncnövekedés A • + M AM • AM n M • AM n +1 M • - láncátadás (a láncvég kialakítása B funkcióvá): AM n M • + AB A - M n +1 - B + A • Ipari példa az etilén polimerizációja széntetraklorid jelenlétében: R • + CCl 4 RCl + • CCl 3 • Cl 3C - (CH 2 - CH 2 )n - CH 2 - C H 2 + CCl 4 Cl 3C - (CH 2 - CH 2 )n +1 - Cl + • CCl 3 http://www.doksihu INHIBÍCIÓ, RETARDÁLÁS A folyamatok lejátszódhatnak - addíciós mechanizmus szerint: R • + Z RZ • vagy R • + Z • RZ - és szubsztitúciós mechanizmus szerint: R • + HZ RH + Z• Az inhibíciót az indukciós periódussal tudjuk jellemezni: t ind
= µ ⋅ Cinh vi ahol µ: sztöchimetriai koefficiens, melynek értéke elvileg 1 vagy 2, gyakorlatilag azonban 0 < µ ≤ 2; C inh inhibitor koncentrációja; v i : az inhibíció sebessége. http://www.doksihu INHIBÍCIÓ, RETARDÁLÁS Inhibitorok vagy retarderek lehetnek: vegyérték telített molekulák: kinonok: . . RO . R+O O O . O R RO OR O R O O . R R + HO R O R R HO OR Aromás nitro-vegyületek: . O - R+ + N RO . Ar N Ar . R ROR + ArN O O O Kondenzált-gyűrűs aromás vegyületek: . R + R . CH R R R http://www.doksihu INHIBÍCIÓ, RETARDÁLÁS Inhibitorok vagy retarderek lehetnek: Stabilizált szabad gyökök: 1. TPM, DPPH, Banfield-gyök (rekombináció játszódik le) 2. Az O 2 is szabad gyök (biradikális, iniciálni is tud!) 3. Változó vegyületű fémek, pl Fe A vas az egyik leggyakrabban használt szerkezeti anyag – jelenlétével és szennyezésével is gyakran számolni kell.
Autoinhibíció . ~ CH2 CH CH2 CH . láncnöv. CH2X CH2X ~ CH2 CH + CH2 CH CH2X CH2X izomerizáció ~ CH2 CH2 . CH X láncátadás ~ CH2 CH2 + CH2 CH CH2X . CHX http://www.doksihu A GYÖKÖS POLIMERIZÁCIÓ KINETIKÁJA A polimerizációs folyamat a következő: I 2R• kb R• + M P1• Pn• + M Pn•+1 kP Pi • + Pj• polimer kt Iniciátor bomlásra a sebességi egyenlet: − dI = kb I dt Gyökképződésre, iniciálásra az alábbi összefüggés írható fel: dR • = k i I = 2k b f I vi = dt f: gyökhasznosítási tényező. ν i : az iniciálás sebessége Propagációra, monomer-fogyásra: vp = − dm = kpr m dt (r = R + ∑ P ) • ν p : a láncnövekedés sebessége A gyökkoncentráció változása az előbbiek felhasználásával: dr = vi − k t r 2 dt • i http://www.doksihu A GYÖKÖS POLIMERIZÁCIÓ KINETIKÁJA A stacionárius állapot (steady state) miatt dr dm r nem konstans, de << dt dt
dr ≈0 dt vi = k t rst2 rst = vi = kt 2k b f ⋅ I kt A stacionárius gyökkoncentrációval a láncnövekedési folyamat sebessége: v p = k p rst m = k p dI - Ha I = I 0 (= konstans), dt << 2k b f kt I ⋅m = K I ⋅m dm : dt a propagáció sebessége: vp = − dm dm = K I0 ⋅ m = − K I 0 dt dt m a differenciál - egyenlet megoldása: ln m0 = K I0 ⋅ t m ahol K I 0 a polimerizáció bruttó sebességi állandója. http://www.doksihu A GYÖKÖS POLIMERIZÁCIÓ KINETIKÁJA - Ha I nem konstans, akkor − dI = k b I I = I 0 e − kb t dt behelyettesitve k t − b dm − = K I0 e 2 ⋅ m dt Ebből k t − b m0 2 k I 0 ln = 1 − e 2 m kb ahol I o az iniciátor kezdeti koncentrációja. Az iniciátor elfogyása utáni határkonverzió („dead-end”) a következő: m0 2 K I 0 ln = m∞ kb http://www.doksihu A GYÖKÖS POLIMERIZÁCIÓ KINETIKÁJA A polimerizáció
sebessége (R p ) és az iniciátor koncentráció négyzetgyöke (I1/2) közötti összefüggés 24 22 20 Rp *106, (mol/l-sec) 18 16 14 12 10 8 6 4 2 0 0,00 0,05 0,10 0,15 0,20 0,25 1/2 [I] , (mol/l) ♦= Metil-metakrilát, benzoil-peroxid, 50 oC =Vinil-benzolát, azo-bisz-izo-butironitril, 60 oC 0,30 http://www.doksihu A GYÖKÖS POLIMERIZÁCIÓ KINETIKÁJA A polimerizáció aktiválási energiája: E = Ep + ahol: 1 1 Eb − Et 2 2 1 E p − Et : a monomerre jellemző ≈15-25 kJ/mol. 2 Eb : az iniciálás módjától, illetve az iniciátortól függ: termikus iniciálásnál ≈ 120-180 kJ/mol A kp redox-rendszernél ≈ 40-60 kJ/mol foto-iniciálásnál ≈ 0 kJ/mol. kt kifejezés értéke a monomertől függ: minél reakcióképesebb a monomerből képződött gyök, annál nagyobb k p kt . Például néhány monomerre a sorrend: VAc > VC > MMA > S (a monomerek reaktivitása fordított sorrendben változik) http://www.doksihu A GYÖKÖK
HOSSZÚSÁG SZERINTI ELOSZLÁSA A különböző gyökök koncentrációjának időbeli változása: dr1 = vi − k p r1 m − k t r1 r dt dr2 = k p r1 m − k p r2 m − k t r2 r dt dri = k p ri −1 m − k p ri m − k t ri r dt dr ∑ : dt = νi − k t (r1 + r2 + . + ri )r = νi − k t r 2 ≈ 0 Rekurzió van, tehát ri = ahol kpm k p m + kt r ⋅ rr −1 = α ⋅ ri −1 α = a láncnövekedés valószínűsége, 1-α = a lánczáródás valószínűsége. Ennek alapján: r1 = νi k p m + kt r = kt r ⋅ r = (1 − α ) ⋅ r k p m + kt r tehát az eloszlás-függvény: ri = (1 − α )α i −1 r Ez geometriai eloszlás. http://www.doksihu A POLIMEREK HOSSZÚSÁG SZERINTI ELOSZLÁSA Diszproporcionálódás esetén a gyökök eloszlása „befagy”: k t , d rP r NP = ∞ ∑k t ,d = rP r rP = (1 − α )α P −1 r P= 1 ahol N p a P polimerizáció fokú részecskék száma. Ez az ún. legvalószínűbb („most probable”), vagy
„Flory”-eloszlás Rekombináció esetén: P −1 Np = ∑k ⋅r ⋅r t ,r P −i i i =1 ∞ P −1 ∑∑ k ⋅ r ⋅ r t ,r P −i i P = 2 i =1 P −1 ∑ (1 − α ) α α 2 i −1 P − i −1 i =1 P −1 = (1 − α ) ∑α P −2 = (1 − α ) (P − 1)α P −2 2 2 i =1 ∞ ∑ (1 − α ) (P − 1)α 2 P−2 ∞ ∞ = (1 − α ) ⋅ 2 P=2 1 =1 (1 − α )2 mert ∞ ∞ d x (α ) = d ∑ α x = dx x =1 P=2 x =1 x =1 dx d [α (1 + α + α 2 + .)] = d α = 1 − α + α2 = 1 2 = dα dα 1 − α (1 − α ) (1 − α ) ∑ (P − 1)α P−2 = ∑ xα x −1 = ∑ Így N p = (1 − α ) (P − 1)α P −2 2




 When reading, most of us just let a story wash over us, getting lost in the world of the book rather than paying attention to the individual elements of the plot or writing. However, in English class, our teachers ask us to look at the mechanics of the writing.
When reading, most of us just let a story wash over us, getting lost in the world of the book rather than paying attention to the individual elements of the plot or writing. However, in English class, our teachers ask us to look at the mechanics of the writing.