Please log in to read this in our online viewer!
Please log in to read this in our online viewer!
No comments yet. You can be the first!
Content extract
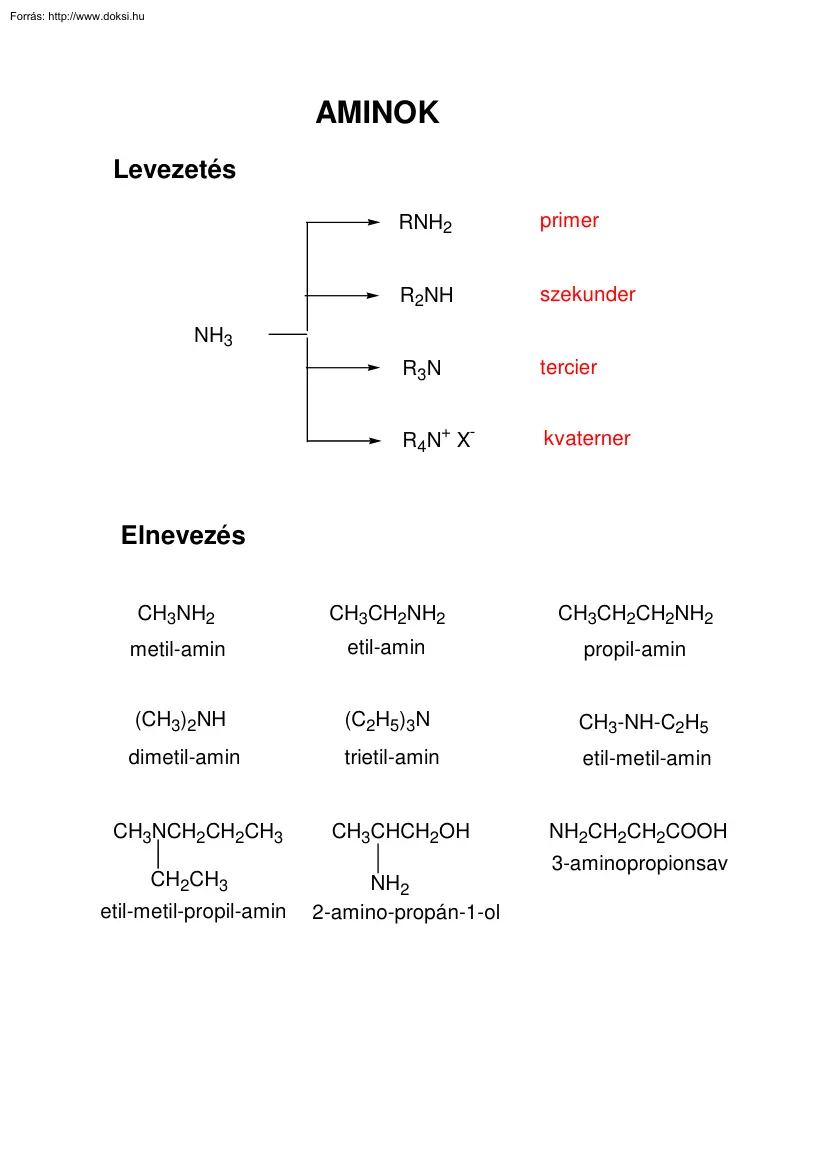
AMINOK Levezetés RNH2 primer R2NH szekunder R3N tercier R4N+ X- kvaterner NH3 Elnevezés CH3NH2 CH3CH2NH2 CH3CH2CH2NH2 metil-amin etil-amin propil-amin (CH3)2NH (C2H5)3N CH3-NH-C2H5 dimetil-amin trietil-amin etil-metil-amin CH3NCH2CH2CH3 CH3CHCH2OH NH2CH2CH2COOH CH2CH3 etil-metil-propil-amin 3-aminopropionsav NH2 2-amino-propán-1-ol Elektron- és térszerkezet N H H H H N H CH3 112° 107° NH NH N a b N c c N a b gyors racemizáció a b d d N N c c rezolválható a b Fizikai tulajdonságok Forráspont CH3NH2 (CH3)2NH (CH3)3N -6 °C 7 °C 3 °C NH2 78 °C 36 °C NH 56 °C N 28 °C 37 °C Hidrogénkötés N H N H N H Sav-bázis tulajdonságok R NH2 Kb = + H2O Kb + R NH3 + OH- [R-NH3+] [OH-] pKb = -lg Kb [R-NH2] pKb NH3 4.70 MeNH2 3.36 Me2NH 3.25 Me3N 4.28 Báziserősség +I effektus NH3< R-NH2 < R2NH > R3N kationok szolvatációs készsége Az amidok szerkezete 122 pm O CH3 C
124° N 147 pm H H3C 139 pm O O CH3 C + C N N H3C H H3C O H forráspont C NH2 CH3 C 206° O H C C O H O 193° N CH3 H N NHCH3 Az amidok sav-bázis tulajdonságai Savasság O CH3 C NH2 R O -H+ pKa~16 CH3 -H+ NH2 C R O NH- CH3 NH- pKa~36 Bázicitás O C -O N δO + N C δ+ C N H+ + HO C N HO C CH3-CO-NH2: pKb = 13.7 + N C NH Nitrilek (R-CN) 180° R C R N C N R + C CH3CN CH3CH2CH2CN acetonitril butánnitril Azidok (R-N3) R N + N N 126 pm R N + N N 112 pm CH3N3 CH3CH2CH2N3 metil-azid propil-azid Nitrovegyületek (R-NO2) O R + N R O - + O N O CH3NO2 CH3CH2CH2NO2 nitrometán 1-nitropropán N Az aminok előálIítása Az ammónia alkilezése NH3 R-X -HX R-X R-NH2 -HX R2NH R-X -HX R-X R 3N RN4+ X- Primer aminok előállítása (Gabriel szintézis) O O NH KOH N- K+ O O R NH2 O H 2N R H2O (OH-) N O R Hofmann lebontás O R C NH2 + Br2 + 4 NaOH R NH2 + 2 NaBr
+ Na2CO3 + 2H2O Mechanizmus O R C O NH + Br Br R C NH Br H O R C OH- H O N C N C N R Br H2 N H2O R O R Curtius lebontás O R - + C N N N -N2 O C R N O C N R H2O H2 N R Az aminok acilezése O Q C Cl O R NH2 + Q C O O O C R Q NH C Q O Q C OEt Az aminocsoport védése O R NH2 + Cl C O O-CH2-C6H5 R-NH C O-CH2-C6H5 O R-NH C O-CH2-C6H5 H2/kat. R-NH2 + CO2 + C6H5-CH3 Hofmann-elimináció C C MeI NH2 C H C N+Me3 I- H Ag2O C -NMe3 C C C N+Me3 OH- H CH3 CH2 CH2 CH CH3 NH2 1. MeI 2. Ag2O CH3 δH OH δCH2 CH2 CH CH2 CH3 δH OH δCH2 CH2 CH N+Me3 CH3 CH2 CH2 CH CH2 96% Hofmann-szabály CH3 N+Me3 CH3 CH2 CH 4% CH CH3 Diazometán (CH2N2) - CH2 + N N - CH + N N 2 Előállítás O NH2 C NO N + KOH CH2N2 + KOCN + 2 H2O CH3 Felhasználás O O R C O H - CH2 + N N R C O- + CH3 + N O R C O Példa COOH COOCH3 CH2N2 CH3 + N2 N A nitrogéntartalmú
vegyületek redukciója LiAlH4 H2/kat. R CH2 NO2 + + R C + + R CH + + N N OH R CH2 NH2 R CH2 N3 + R CO NH2 + R CO N3 + Aromás aminok Bázicitás pKb NH2 NH2 NH2 9.4 3.3 NH2 NH2 NH2 - - - pKb NH2 NH2 NH2 NO2 OCH3 12.9 8.7 Elektrofil szubsztitúciós reakciók NH2 NH2 NH2 X + X+ + X NH-CO-CH3 NH-CO-CH3 NH-CO-CH3 X + X+ + X Példa NH-CO-CH3 + Br2 NH-CO-CH3 NH2 1. H2O/H+ 2. NaOH -HBr Br Br Diazotálás 0 °C Ar-NH2 + NaNO2 + 2 HCl HO N H+ O + H 2O N Ar-N2+ Cl- + NaCl + 2 H2O -H2O O +N O nitrozil kation H Ar N + + Ar NO H Ar + N H + N N H O Ar N N O Ar N N OH H N -H2O Ar N N + OH2 H+ elektronküldő X: segít X H elektronvonzó X: gátol N H +N O gátol H + segít HNO2 Diazóniumsók szubsztitúciós reakciói H2O KI CuBr Ar-N2+ CuCl CuCN HBF4 H3PO2 Ar OH Ar I Ar Br Ar Cl Ar CN Ar F Ar H Mechanizmus ionos (H2O, KI) + Ar N N -N2 I- + Ar Ar
I gyökös (Sandmeyer reakció, CuBr, CuCl, CuCN Ar + N N + . CuI -N2 -Cu II . Ar . Cl Ar Cl A diazóniusók kapcsolási reakciói + N X + N Y SE X N + N Y H -H+ X N N Y elektronvonzó X segít elektronküldő Y (pl. OH, NMe2) pH függés lúgos közeg Ar + N N + OH- Ar N N OH savas közeg Ar NMe2 + H+ Ar pH optimum: 5-7 + NHMe2 Ar N N O- Aromás nitrovegyületek Elektrofil szubsztitúciós reakciók NO2 NO2 + X+ X meta irányítás dezaktiválás Redukció aminná Ar NO2 Ar NO Ar NH-OH Ar redukálószerek: H2/kat. fém + sav (Sn, Zn, Fe) NH2
124° N 147 pm H H3C 139 pm O O CH3 C + C N N H3C H H3C O H forráspont C NH2 CH3 C 206° O H C C O H O 193° N CH3 H N NHCH3 Az amidok sav-bázis tulajdonságai Savasság O CH3 C NH2 R O -H+ pKa~16 CH3 -H+ NH2 C R O NH- CH3 NH- pKa~36 Bázicitás O C -O N δO + N C δ+ C N H+ + HO C N HO C CH3-CO-NH2: pKb = 13.7 + N C NH Nitrilek (R-CN) 180° R C R N C N R + C CH3CN CH3CH2CH2CN acetonitril butánnitril Azidok (R-N3) R N + N N 126 pm R N + N N 112 pm CH3N3 CH3CH2CH2N3 metil-azid propil-azid Nitrovegyületek (R-NO2) O R + N R O - + O N O CH3NO2 CH3CH2CH2NO2 nitrometán 1-nitropropán N Az aminok előálIítása Az ammónia alkilezése NH3 R-X -HX R-X R-NH2 -HX R2NH R-X -HX R-X R 3N RN4+ X- Primer aminok előállítása (Gabriel szintézis) O O NH KOH N- K+ O O R NH2 O H 2N R H2O (OH-) N O R Hofmann lebontás O R C NH2 + Br2 + 4 NaOH R NH2 + 2 NaBr
+ Na2CO3 + 2H2O Mechanizmus O R C O NH + Br Br R C NH Br H O R C OH- H O N C N C N R Br H2 N H2O R O R Curtius lebontás O R - + C N N N -N2 O C R N O C N R H2O H2 N R Az aminok acilezése O Q C Cl O R NH2 + Q C O O O C R Q NH C Q O Q C OEt Az aminocsoport védése O R NH2 + Cl C O O-CH2-C6H5 R-NH C O-CH2-C6H5 O R-NH C O-CH2-C6H5 H2/kat. R-NH2 + CO2 + C6H5-CH3 Hofmann-elimináció C C MeI NH2 C H C N+Me3 I- H Ag2O C -NMe3 C C C N+Me3 OH- H CH3 CH2 CH2 CH CH3 NH2 1. MeI 2. Ag2O CH3 δH OH δCH2 CH2 CH CH2 CH3 δH OH δCH2 CH2 CH N+Me3 CH3 CH2 CH2 CH CH2 96% Hofmann-szabály CH3 N+Me3 CH3 CH2 CH 4% CH CH3 Diazometán (CH2N2) - CH2 + N N - CH + N N 2 Előállítás O NH2 C NO N + KOH CH2N2 + KOCN + 2 H2O CH3 Felhasználás O O R C O H - CH2 + N N R C O- + CH3 + N O R C O Példa COOH COOCH3 CH2N2 CH3 + N2 N A nitrogéntartalmú
vegyületek redukciója LiAlH4 H2/kat. R CH2 NO2 + + R C + + R CH + + N N OH R CH2 NH2 R CH2 N3 + R CO NH2 + R CO N3 + Aromás aminok Bázicitás pKb NH2 NH2 NH2 9.4 3.3 NH2 NH2 NH2 - - - pKb NH2 NH2 NH2 NO2 OCH3 12.9 8.7 Elektrofil szubsztitúciós reakciók NH2 NH2 NH2 X + X+ + X NH-CO-CH3 NH-CO-CH3 NH-CO-CH3 X + X+ + X Példa NH-CO-CH3 + Br2 NH-CO-CH3 NH2 1. H2O/H+ 2. NaOH -HBr Br Br Diazotálás 0 °C Ar-NH2 + NaNO2 + 2 HCl HO N H+ O + H 2O N Ar-N2+ Cl- + NaCl + 2 H2O -H2O O +N O nitrozil kation H Ar N + + Ar NO H Ar + N H + N N H O Ar N N O Ar N N OH H N -H2O Ar N N + OH2 H+ elektronküldő X: segít X H elektronvonzó X: gátol N H +N O gátol H + segít HNO2 Diazóniumsók szubsztitúciós reakciói H2O KI CuBr Ar-N2+ CuCl CuCN HBF4 H3PO2 Ar OH Ar I Ar Br Ar Cl Ar CN Ar F Ar H Mechanizmus ionos (H2O, KI) + Ar N N -N2 I- + Ar Ar
I gyökös (Sandmeyer reakció, CuBr, CuCl, CuCN Ar + N N + . CuI -N2 -Cu II . Ar . Cl Ar Cl A diazóniusók kapcsolási reakciói + N X + N Y SE X N + N Y H -H+ X N N Y elektronvonzó X segít elektronküldő Y (pl. OH, NMe2) pH függés lúgos közeg Ar + N N + OH- Ar N N OH savas közeg Ar NMe2 + H+ Ar pH optimum: 5-7 + NHMe2 Ar N N O- Aromás nitrovegyületek Elektrofil szubsztitúciós reakciók NO2 NO2 + X+ X meta irányítás dezaktiválás Redukció aminná Ar NO2 Ar NO Ar NH-OH Ar redukálószerek: H2/kat. fém + sav (Sn, Zn, Fe) NH2



 Just like you draw up a plan when you’re going to war, building a house, or even going on vacation, you need to draw up a plan for your business. This tutorial will help you to clearly see where you are and make it possible to understand where you’re going.
Just like you draw up a plan when you’re going to war, building a house, or even going on vacation, you need to draw up a plan for your business. This tutorial will help you to clearly see where you are and make it possible to understand where you’re going.